 【リークカリウムチャネルの睡眠時間制御への関与を発見】
【リークカリウムチャネルの睡眠時間制御への関与を発見】
1.発表者:
上田 泰己(東京大学大学院医学系研究科 機能生物学専攻 システムズ薬理学分野 教授
/理化学研究所生命機能科学研究センター合成生物学研究チーム チームリーダー、東京大学ニューロインテリジェンス国際研究機構主任研究者 兼任)
吉田 健祐(東京大学医学部 6年生:研究当時)
史 蕭逸(東京大学大学院医学系研究科 機能生物学専攻 システムズ薬理学分野 助教 /理化学研究所 客員研究員 兼任)
2.発表のポイント:
◆睡眠時に大脳皮質の神経細胞で観察される発火パターン(徐波発火パターン:注1)の新規の数理モデルに基づいてリークカリウムチャネルが睡眠制御に重要であることを予測し、本予測を遺伝子改変マウスの睡眠測定により世界で初めて実証した。
◆これまでより詳細な数学的解析が可能な徐波発火パターンの数理モデルを作成した。さらに数理モデルにより重要であると予測されたリークカリウムチャネルが睡眠時間制御に実際に関わっていることを動物実験で示し、睡眠時間を制御する遺伝子としてKcnk9を新たに発見した。
◆今回作成した数理モデルにより徐波発火パターン形成における他のチャネルの役割も予測できる可能性があり、睡眠時間制御の分子機構の解明につながることが期待される。
3.発表概要:
東京大学大学院医学系研究科 機能生物学専攻薬理学専攻 システムズ薬理学分野の上田泰己教授(理化学研究所生命機能科学研究センター合成生物学研究チーム チームリーダー兼任、東京大学ニューロインテリジェンス国際研究機構 主任研究者兼任)、吉田健祐学生(研究当時:医学部6年生)、史蕭逸助教(理化学研究所 客員研究員兼任)らの研究グループは、ホジキン・ハクスレーモデルをベースにした数理モデルと網羅的遺伝子ノックアウト技術(トリプルCRISPR法:注2)・非侵襲で並列化可能な睡眠測定法(SSS法:注3)を用いて、リークカリウムチャネル(注4)が睡眠時間の制御において重要な役割を果たすことを示しました。
ヒトをはじめとする哺乳類で睡眠時間がどのように制御されているかはよくわかっていません。睡眠中、特に徐波睡眠中は特徴的な大脳皮質の神経細胞の発火パターン(徐波発火パターン)が観察されます。これまで本研究グループの研究によって、徐波発火パターン形成と睡眠時間の制御は一部の制御機構を共有している可能性が示唆されています。今回、本研究グループはまず、神経細胞の数理モデルを用いた徐波発火パターン形成機構の解析を行い、リークカリウムチャネルが徐波発火パターンの形成に重要な役割を果たしている可能性を明らかにしました。その後トリプルCRISPR法とSSS法を組み合わせることで、リークカリウムチャネルがカルシウム依存的な過分極(注5)と協調的に徐波発火パターン形成に寄与している可能性を明らかにし、リークカリウムチャネルファミリーに含まれる遺伝子の網羅的ノックアウト実験から、Kcnk9が睡眠時間制御に重要な役割を果たすことを明らかにしました。この結果は、徐波発火パターン形成・睡眠時間制御におけるリークカリウムチャネルの役割を示すとともに、二つの現象の裏には共通する制御機構がある可能性を再度強調するものであり、睡眠時間の制御機構の解明に大きく貢献すると期待できます。
本研究は、米国の科学雑誌『Proceedings of the National Academy of Sciences of the United States of America』(9月17日付け:日本時間9月18日)に掲載されます。
4.発表内容:
【背景】
動物の状態は覚醒、レム睡眠、ノンレム睡眠の三つに分類され、それぞれの状態は脳波と筋電図で定義されます。脳波は脳の神経細胞の活動をマクロにとらえたものですが、一神経細胞レベルでもノンレム睡眠時と覚醒やレム睡眠時では活動が異なっています。ノンレム睡眠時に大脳皮質の神経細胞では、Down state, Up stateの2つの状態が交互に行き来する徐波発火パターンと呼ばれる特徴的な波形が観察されます(図1左)。
近年、本研究グループは平均場近似を参考にした手法を用いることで、「平均化された一神経細胞」で徐波発火パターンを再現するようなAveraged-Neuron (AN) モデルを作成しました。ANモデルにおいて特定のチャネルの透過性を変化させたときの発火パターンの変化を調べることで、徐波発火パターン形成にはカルシウム依存的な過分極が本質的に働くという予測が得られました。実際にカルシウム依存的な過分極に関連するチャネルのノックアウトマウスを作製したところ、そのうちのいくつかの遺伝子(Kcnn2, Kcnn3, Cacna1h, Cacna1g, Atp2b3)について個体の睡眠時間が変化することを示しました。この結果は徐波発火パターンの形成と睡眠時間制御が共通の機構により制御される可能性を示唆しており、徐波発火パターン形成のメカニズムをさらに解明することが睡眠時間制御機構の解明にもつながることを示唆します。
ANモデルは徐波発火パターン形成を一細胞レベルで説明した有望なモデルであるため、さらに詳細な解析をおこなうことで徐波発火パターンの形成の詳しい数学的機構やカルシウム関連チャネル以外のチャネルを解析することが可能となります。そこで、本研究グループは、ANモデルのうち徐波発火パターン形成に本質的に働くチャネルを抽出したSimplified AN (SAN) モデルを作成し、徐波発火パターン形成・睡眠時間制御機構に関与する新たなチャネルの同定を試みました。
【研究手法と成果】
本研究グループはまず徐波発火パターン形成のモデルであるANモデルの重要な要素を残しつつ単純化をおこないました。単純化の際には、ANモデルにおいて特定のチャネルがある状態とない状態で、ランダムにパラメーターを設定したときに徐波発火パターンが出る確率の比較をおこない、徐波発火パターンが出る確率に大きな影響を与えるようなチャネルを選択しモデルに残すことで、より単純なモデルであるSANモデルの作成に成功しました。具体的にはANモデルがチャネル・ポンプ数13個、変数10個であったのに対してSANモデルはチャネル・ポンプ6個、変数3個にまで単純化されています(図2)。また、このような客観的指標を用いてモデルの作成をおこなったため、SANモデルはANモデルを自然に単純化したものであり徐波発火パターン形成の有用なモデルになると考えられました。
モデルが単純化されたことにより、SANモデルを用いて新たにさまざまな解析が可能になりました。まず徐波発火パターンにおける電流の解析をおこなうと、徐波発火パターンに特徴的なDown stateにおいて、以前から睡眠への関与が知られていたカルシウム依存性カリウムチャネルに加えてリークカリウムチャネルが働いていることがわかりました。さらにカルシウム依存的な過分極に関連したチャネルの透過性を低下させた状態でリークカリウムチャネルの透過性を低下させると、徐波発火パターンから覚醒時の発火パターン(図1右)に変化することがわかりました。そこでこれらのチャネルと相平面上のヌルクライン(注6)との関係を調べることにより、リークカリウムチャネルとカルシウム依存性カリウムチャネルが共同してUp stateからDown stateへの移行に関与していることが明らかになりました(図3)。これによりリークカリウムチャネルの透過性を下げると徐波発火パターンが覚醒時の発火パターンに変化することがわかりました。
これらの結果のうち検証可能なものについては、ANモデルでも同様の結果が得られました。以上のことにより、リークカリウムチャネルの透過性が低いと徐波発火パターンではなく覚醒時の発火パターンが出現することがわかりました。このことからリークカリウムチャネルの発現が低下した状態では神経細胞では徐波発火パターンが出にくく、大脳皮質全体として徐波が出にくくなると考えられ、その結果睡眠時間が減少すると予測されました。
実際にこの予測をマウスの個体レベルで検証しました。まず、1次スクリーニングといてトリプルCRISPR法でリークカリウムチャネル遺伝子を一つずつ欠失させたマウスを作製し、高速に睡眠表現型を解析することができるSSS法により睡眠量を測定しました。その結果、二つのリークカリウムチャネル(Kcnk9またはKcnk16)を欠失したマウスにおいて睡眠時間の有意な減少が観察され、特にKcnk9を欠失したマウスについては睡眠時間が著しく減少していました(図4左)。そこで、Kcnk9遺伝子欠失マウスの睡眠量を、脳波・筋電図測定を用いてより詳細に解析したところ、Kcnk9遺伝子欠失マウスは睡眠時間のうちノンレム睡眠の時間が著しく減少していることがわかりました(図4右)。このように、徐波発火パターンの形成への関与が示唆されたリークカリウムチャネルが、マウスの睡眠時間制御にも関与していることが動物実験で示されました。
【今後の期待】
本研究では、徐波発火パターン形成に対する従来のモデルの単純化をおこなうことにより、徐波発火パターン形成の機構をより詳細に明らかにし、リークカリウムチャネルの関与を予測しました。さらに、リークカリウムチャネル遺伝子の欠失マウスを作製することで、リークカリウムチャネルが睡眠時間制御に関与することを示しました。
本研究のSANモデルは徐波発火パターン形成の数学的機構をこれまでより詳細に解明することに成功しており、その他のチャネルが徐波形成にどのように働くかを予測しうるものとなっています。今後リークチャネルを含め一つの神経細胞レベルの構成因子が、回路レベルの機構とどのように関与しているか解明されることが期待されます。
5.発表雑誌:
雑誌名:Proceedings of the National Academy of Sciences of the United States of Americaオンライン版(日本時間:9月18日)
論文タイトル:Leak potassium channels regulate sleep duration
著者:Kensuke Yoshida*, Shoi Shi*, Maki Ukai-Tadenuma, Hiroshi Fujishima, Rei-ichiro Ohno, and Hiroki R. Ueda#
(*Co-first, #Lead contact)
6.問い合わせ先:
【研究に関する問い合わせ】
東京大学大学院医学系研究科 機能生物学専攻 システムズ薬理学分野
教授 上田 泰己 (うえだ ひろき)
【報道に関する問い合わせ】
東京大学医学部総務係
E-mail:ishomu@m.u-tokyo.ac.jp
8.用語解説:
(注1)徐波発火パターン
徐波睡眠中に大脳皮質の神経細胞で観察される特徴的な神経発火パターン。発火を繰り返すUp stateと過分極するDown stateを繰り返すことが特徴である(添付資料図1を参照)。
(注2)トリプルCRISPR法
共同研究者らにより開発された手法で、CRISPR(CRISPR/Cas系を用いたゲノム編集技術の一つ)を改良し、3種類のガイドRNAを用いて、一世代目で極めて高い確率(ほぼ100%)でノックアウトマウスを作製できる(2016年1月8日理化学研究所プレスリリース「次世代型逆遺伝学による睡眠遺伝子Nr3aの発見」 http://www.riken.jp/pr/press/2016/20160108_1/)。
(注3)SSS法
共同研究らにより開発された手法で、呼吸パターンを用いて、非侵襲的かつ高効率に睡眠表現型解析をおこなう。レム睡眠、ノンレム睡眠を区別することはできないが、外科的な手術を伴わないため、脳波に比べて多種類のマウスの睡眠を測定することが容易である。
(注4)リークカリウムチャネル
カリウムチャネルの一種であり、静止膜電位に深く関与することが知られている。
(注5)カルシウム依存的な過分極
細胞内カルシウムイオン濃度の上昇がカルシウム依存性カリウムチャネルを活性化し、外向きカリウム電流が増加することで過分極が引き起こされる。本研究グループが過去に睡眠への関与を報告している (2018年3月18日プレスリリース「なぜ私たちは眠るか~眠りの素は細胞内カルシウム?~」 https://www.jst.go.jp/pr/announce/20160318/index.html)。
(注6)ヌルクライン
微分方程式の挙動を解析する際に用いられる手法である。特に2変数微分方程式において各変数を軸とした相平面を考え、各方向の微分が0となる曲線であるヌルクラインをプロットすることで微分方程式のおおよその挙動を予測することができる。
9.添付資料:
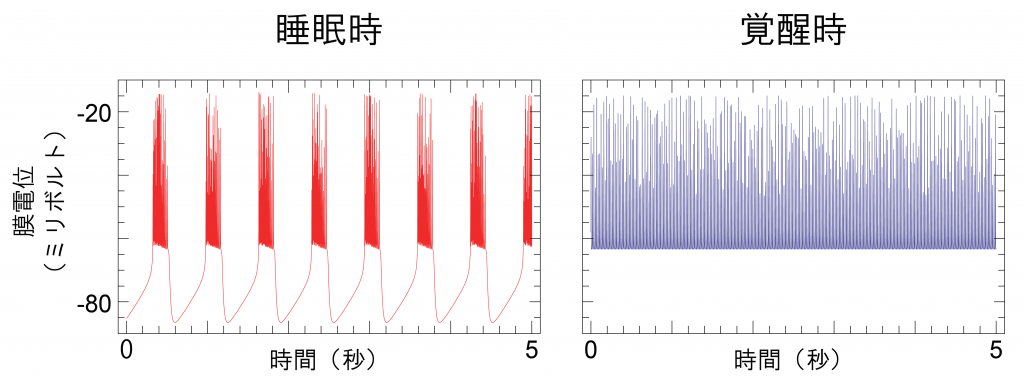
図1 覚醒、睡眠時の一神経細胞の波形例
睡眠時の大脳皮質神経細胞で観察される徐波発火パターン波形(赤)。発火を繰り返すUp
stateと過分極するDown stateを繰り返すことが特徴である。一方、覚醒時などに観察され
るバースト発火パターン(青)ではDown stateが観察されない。
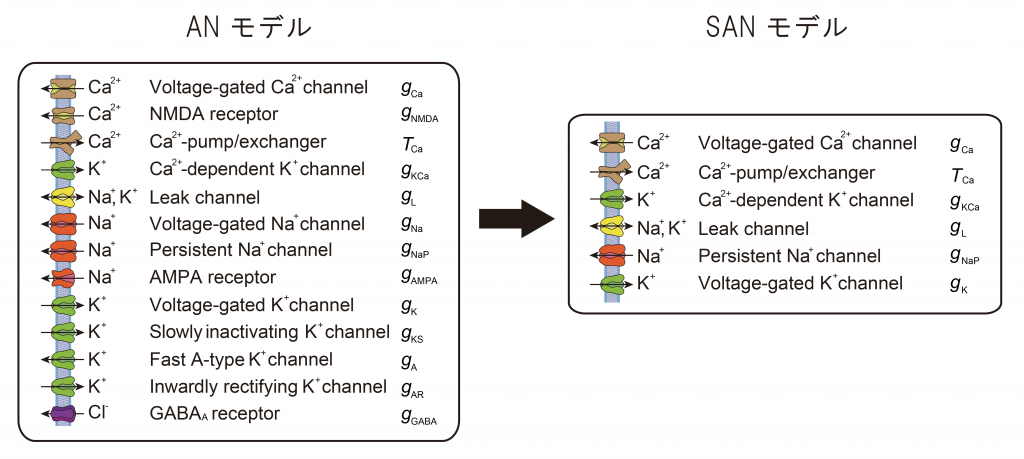
図2 ANモデル、SANモデルの構成要素
ANモデルにはチャネル・ポンプが13個あったのに対して、SANモデルでは6個まで減らすことに成功している。
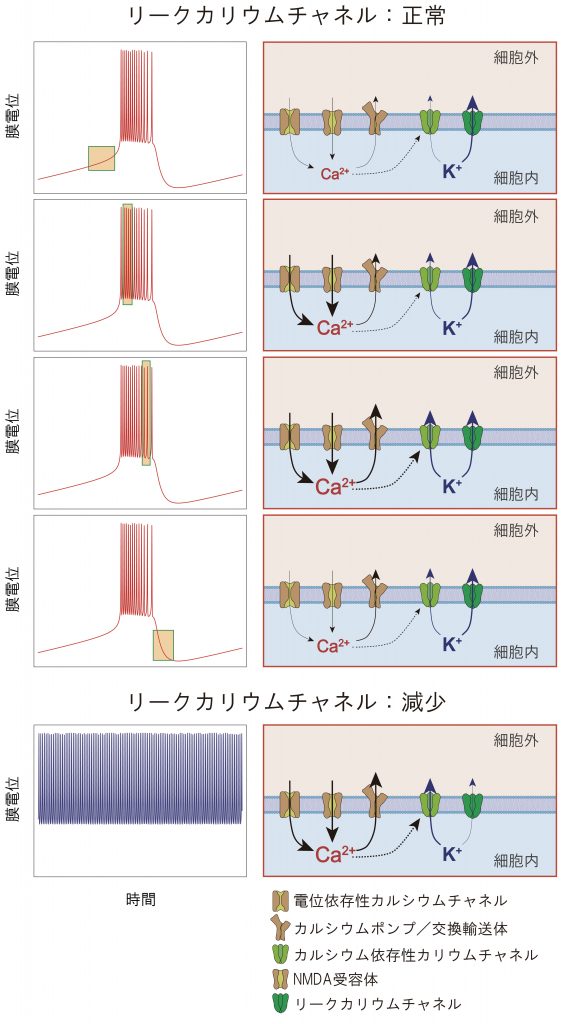
図3 徐波発火パターン形成機構とリークカリウムチャネルの関係
リークカリウムチャネルが正常のときは細胞内カルシウム濃度上昇により活性化されたカルシウム依存性カリウムチャネルとリークカリウムチャネルの働きによりUp stateからDown stateに移行する。一方、リークカリウムチャネルが減少している状態では、細胞内カルシウム濃度が上昇してもカルシウム依存性カリウムチャネルとリークカリウムチャネルを通る外向き電流が十分量に達しないため、Up stateからDown stateに移行しない。
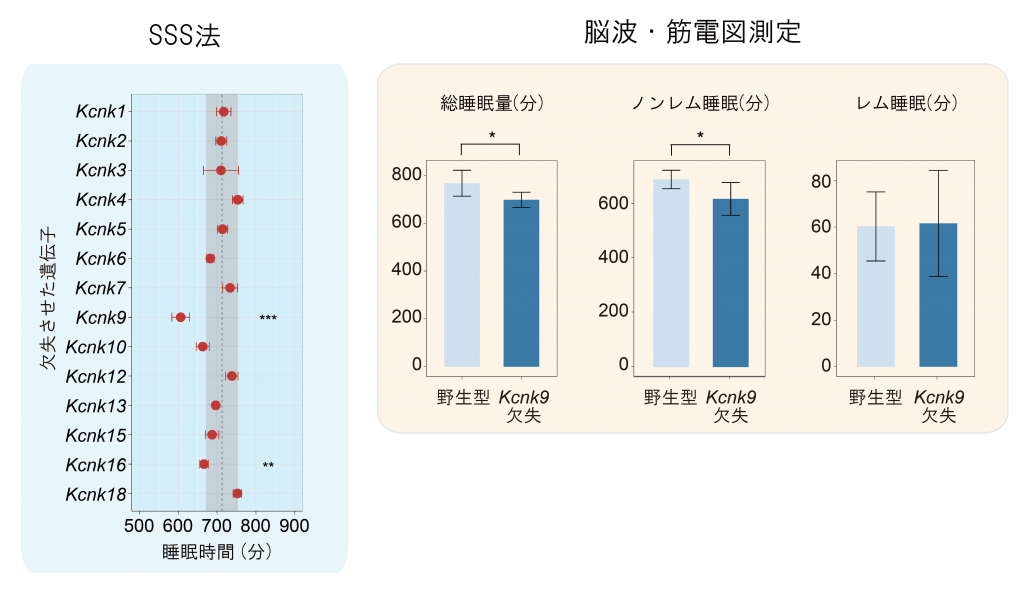
図4 リークカリウムチャネル欠失マウスの睡眠時間
左図はSSS法で測定したリークカリウムチャネル欠失マウスの睡眠時間を示している。灰色部分が野生型の平均値±標準偏差を示しており、Kcnk9欠失マウスでは睡眠時間が顕著に減少している。右図は脳波・筋電図で測定したKcnk9欠失マウスの総睡眠、ノンレム睡眠、レム睡眠の時間を示している。


