1. 発表者:
狩野 方伸(東京大学大学院医学系研究科 機能生物学専攻 神経生理学分野 教授/国際高等研究所 ニューロインテリジェンス国際研究機構(WPI-IRCN)副機構長・主任研究者)
長濱 健一郎(東京大学大学院医学系研究科 機能生物学専攻 神経生理学分野 博士研究員:研究当時/現 Johns Hopkins University 博士研究員)
上阪 直史(東京大学大学院医学系研究科 機能生物学専攻 神経生理学分野 講師:研究当時/現 東京医科歯科大学大学院医歯学総合研究科認知神経生物学分野 教授)
2. 発表のポイント:
◆ 幻覚や妄想の症状を示す精神疾患である統合失調症が発症するメカニズムはほとんどわかっていませんが、最近の研究により、ヒストン修飾酵素をコードするSETD1A遺伝子の変異が統合失調症の発症リスクを高めることが知られています。研究グループは統合失調症患者のSETD1A遺伝子の変異と同等の変異を持つマウスを作製し、大脳前頭前野の神経回路の働きやマウスの行動を包括的に調べました。
◆ Setd1a変異マウスの大脳前頭前野では遺伝子発現異常と神経細胞間で興奮を伝えるシナプス伝達の低下がみられ、行動解析では、統合失調症の症状を反映する様々な行動異常を示しました。これらの結果から、SETD1Aが大脳前頭前野の興奮性シナプス機能を制御しており、その異常が統合失調症の発症の一因になる可能性を新たに提案しました。
◆ 統合失調症を含む精神疾患の発症原因の一つと考えられているヒストン修飾と、脳内遺伝子発現、シナプス機能、行動との関係を解明したことで、統合失調症の病態解明や治療戦略の開発に貢献することが期待されます。
3.発表概要:
統合失調症は、幻覚・妄想、社会活動の低下や情報処理能力の低下など多彩な臨床症状を示すことが知られています。近年の大規模な遺伝子解析で、多数の遺伝子が病態に関与することが示唆されています。しかし、それらの遺伝子変異が神経細胞においてどのような機能的な異常を引き起こし、統合失調症の発症にどれだけ影響を及ぼすのかよくわかっていません。
今回、東京大学大学院医学系研究科機能生物学専攻神経生理学分野の長濱健一郎研究員(研究当時)、上阪直史講師(研究当時)と狩野方伸教授らの研究グループは、ヒトで統合失調症の発症に強く関与することが知られている遺伝子SETD1A(注1)に注目しました。ヒトの統合失調症患者でみられるSETD1Aの変異と同等の変異を持つ新たな遺伝子変異マウスを作製し、その解析によって、Setd1a遺伝子の機能低下が大脳前頭前野の神経回路の働きに障害を起こし、統合失調症と関連する行動異常を起こすことを発見しました。
研究グループは統合失調症患者で発症に強く関連する遺伝子変異を再現したSetd1a変異マウスをゲノム編集技術により作製し、遺伝子発現、神経回路の働き、マウスの行動について、包括的な解析を行いました。その結果、このマウスは統合失調症によく似た(幅広く臨床的特徴を反映している)行動異常を示すことがわかりました。またSetd1a遺伝子の発現低下によって、大脳前頭前野において、神経細胞同士の機能的な結合を反映する興奮性のシナプス伝達(注2)が、一部の神経細胞(2/3層の錐体細胞)において低下し、マウスの社会性行動の異常が起こることがわかりました。統合失調症患者は、症状の一部として社会生活の中での会話や行動に障害を持ち、現存の薬物治療にも抵抗性を示すことが多く、治療が難しいことが知られています。本研究の成果は、複数の精神疾患に共通してみられる社会性障害のメカニズム解明に貢献するとともに、統合失調症の治療抵抗性の症状へのシナプス機能を標的とした新規治療法開発に貢献することが期待されます。
本研究は、科学研究費補助金(課題番号:18H04012、19H05204、19H05253)の助成を受けて行われました。また、国立研究開発法人日本医療研究開発機構(AMED)の「革新的技術による脳機能ネットワークの全容解明プロジェクト」の一環として実施されました。
4.発表内容:
① 研究の背景・先行研究における問題点
統合失調症は、生涯のうちに人口の約100人に1人弱(0.7 %)が罹患する一般的な病気です。陽性症状(幻覚・妄想など)、陰性症状(意欲や社会活動の低下など)、認知機能障害(作業記憶、注意力、情報処理能力の低下など)の症状があり、10代後半から30代前半の若年者が多く罹患することからも、社会的な影響の大きな病気として知られています。遺伝的・環境的要因の両方が発症に関与する多因子疾患であり、近年の大規模な遺伝子解析で、100個以上の遺伝子の関与が示唆されています。それら関連遺伝子の中で、両親が健常者の統合失調症患者に生じる親が持たない新たな遺伝子変異(デ・ノボ変異)が、統合失調症を含む精神疾患の発症確率を上げる重要な遺伝子変異として注目されてきています。しかし、統合失調症では実際の患者で同定されているデ・ノボ変異が、如何にして統合失調症の発症につながるのか、その全貌は未だわかっていませんでした。
本研究では、近年精神疾患の病態研究において多数の関連遺伝子の発現機構に関わると考えられているヒストン修飾酵素(注3)の遺伝子SETD1Aに着目しました。SETD1Aは、一部の統合失調症患者で稀なデ・ノボ変異が複数報告されており、その遺伝子変異があることで統合失調症が発症する確率が著しく上がる可能性があります。しかし、SETD1Aのデ・ノボ変異がどのような遺伝子発現の変化を生じ、どのような影響を神経回路の働きに及ぼすのかは不明なままでした。
② 研究内容(具体的な手法など詳細)
研究グループは、まず統合失調症の分子機構・神経回路におけるSETD1Aのデ・ノボ変異の役割を解析するために、患者で同定されたデ・ノボ変異を再現した遺伝子変異を持つマウス(Setd1a変異マウス)をゲノム編集技術であるCRISPR/Cas9法(注4)を用いて作製し、多角的な行動実験を行いました。従来のモデル動物では、統合失調症に特徴的な全ての症状を再現することはできませんでした。しかし、研究グループが新たに作製したSetd1a変異マウスは、統合失調症の陽性症状に関連する活動量の上昇、陰性症状の一部を反映する社会性行動の低下、認知機能障害のひとつである作業記憶障害、意欲の低下に関連した回避行動の異常など、統合失調症の臨床的特徴をより幅広く再現することができました。次に統合失調症の病態で重要な脳部位と考えられる内側前頭前野(注5)での機能的・形態学的な解析を行った結果、シナプスの構成要素であるシナプス前部・後部(注6)両者の異常によりグルタミン酸による興奮性シナプス伝達が低下していることが分かりました。また、クロマチン免疫沈降シーケンス(注7)やRNAシーケンス(注8)を行った結果、SETD1Aがヒストンメチル化を通して、遺伝子レベルでもシナプスに影響し、他の様々な精神疾患の病態にも関与する可能性を見出しました。最後に内側前頭前野において、一部の神経細胞特異的にSetd1aを発現低下させたところ、統合失調症患者で治療の難しい陰性症状のひとつである社会性障害のみをマウスで再現でき、そのメカニズムの一端として一部の細胞への興奮性シナプス伝達が重要であることが明らかになりました。
③ 社会的意義・今後の予定 など
統合失調症は、多数の関連遺伝子の報告とともにその病態の基盤としてシナプス機能異常の重要さが指摘されています。その中でSETD1Aは統合失調症の発症の確率上昇に強く関与する初めてのヒストン修飾酵素であり、今回の研究により分子・神経回路基盤における詳細な役割とその一部細胞での発現低下が、興奮性シナプスを介して治療の難しい社会性障害へ関与することが明らかになりました。最近、同じSETD1A遺伝子についての別の遺伝子改変マウスで、社会性障害と同様に治療抵抗性の作業記憶異常に対する新規治療薬候補の報告がされています。今後、Setd1a遺伝子変異マウスを用いて個々の行動学的異常のメカニズムを解明することにより、従来困難だった統合失調症の病態の全容解明や統合失調症の各症状に対する新規治療法の開発が促進することが期待されます。
5.発表雑誌:
雑誌名:「Cell Reports」
論文タイトル:Setd1a Insufficiency in Mice Attenuates Excitatory Synaptic Function and Recapitulates Schizophrenia-Related Behavioral Abnormalities
著者:Kenichiro Nagahama, Kazuto Sakoori, Takaki Watanabe, Yusuke Kishi, Keita Kawaji, Michinori Koebis, Kazuki Nakao, Yukiko Gotoh, Atsu Aiba, Naofumi Uesaka, & Masanobu Kano
DOI番号:10.1016/j.celrep.2020.108126
6.問い合わせ先:
<研究内容に関するお問い合わせ>
東京大学大学院医学系研究科 機能生物学専攻 神経生理学分野
教授 狩野 方伸(かのう まさのぶ)
<広報に関するお問い合わせ>
東京大学医学部総務チーム(総務担当)
<AMEDについてのお問い合わせ>
日本医療研究開発機構 疾患基礎研究事業部 疾患基礎研究課
革新的技術による脳機能ネットワークの全容解明プロジェクト
7.用語解説:
(注1) SETD1A:ヒストンH3リジン4メチル化酵素。細胞核内に存在し、クロマチン(染色体)の主要な構成タンパクであるヒストンタンパクにメチル基を付加する化学反応を触媒しています。一般的に、ヒト遺伝子はSETD1A、マウス遺伝子はSetd1a、タンパク質は共にSETD1Aと記載します。 マウスを用いた研究では、SETD1Aが胎生期から完全に欠損することで、致死することが報告されています。
(注2)シナプス伝達:特定の神経伝達物質を介した神経細胞間での情報伝達。 マウス内側前頭前野(注5)では主にグルタミン酸が関与する興奮性シナプス伝達とγアミノ酪酸(GABA)が関与する抑制性シナプス伝達の2種類があります。
(注3)ヒストン修飾酵素:メチル基、アセチル基などの炭化水素基をヒストンタンパクに付加する化学反応を触媒する酵素。
(注4)CRISPR/Cas9法: 標的とする遺伝子配列を、任意の位置で切断・編集できるゲノム編集技術。
(注5)内側前頭前野:ヒトでは作業記憶、意欲、意思決定、社会性などの高次機能に関与することが知られている脳部位。ヒト脳機能画像研究で、統合失調症の症状・病態との関連が知られています。今回は、マウス内側前頭前野2/3層で、70-80%程度を占めている興奮性シナプス伝達を担う錐体神経細胞に着目してシナプス機能の解析を行いました。
(注6)シナプス前部・後部:シナプスの構成要素。シナプスは、神経伝達物質を含む小胞が集まっている(シナプス前部)部位と伝達物質の受容体が集まっている(シナプス後部)部位から成り立っています。
(注7)クロマチン免疫沈降シーケンス:細胞または組織から特異的な免疫抗体を用いて沈殿させたDNA結合タンパク質を基に、特定のタンパク質が結合しているDNAの配列を次世代型シーケンサーで解析し、タンパク質とゲノムDNAの結合部位の検出と結合の強さの定量を行う手法。
(注8)RNAシーケンス:細胞または組織から抽出したRNAを逆転写して得られた相補的DNAを基に、次世代型シーケンサーによって、タンパク質として発現している遺伝子量を解析・定量する手法。
8.添付資料:
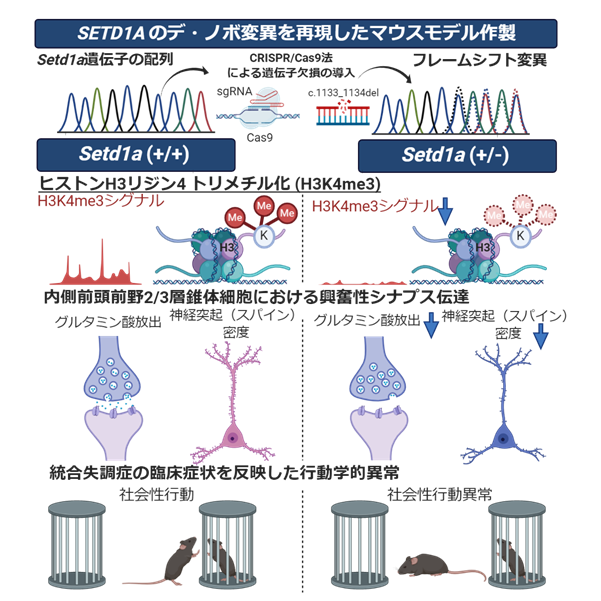
本研究の成果のまとめ
(左)野生型マウス(Setd1a (+/+)マウス)では、SETD1A酵素の働きによりヒストンH3リジン4トリメチル化が起こり、内側前頭前野で興奮性シナプス伝達が制御され、社会性行動を含む各種行動を示す。
(右)Sed1a変異マウス(Setd1a (+/−)マウス)では、SETD1A酵素の発現低下に伴い、ヒストンH3リジン4トリメチル化の修飾異常が起こり、興奮性シナプス前部・後部の異常によるシナプス伝達低下が生じ、最終的に社会性行動異常を含む統合失調症関連行動異常を呈する。


