【本研究のポイント】
【研究概要】
現在、mRNAワクチンによりCOVID-19による重症化や死亡のリスクは著しく低減されました。一方で、呼吸器ウイルスによるパンデミックでは、ヒト間伝播を制御・予防する課題が浮き彫りになりました。本研究成果により、粘膜免疫を標的とした次世代のワクチン開発が加速され、将来、呼吸器系ウイルスによるヒト間伝播を予防し、パンデミックを制御するための新たな戦略を与えることが期待されます。
本研究成果は、2023年12月19日午前5時(日本時間)付国際学術雑誌「Proceedings of the National Academy of Sciences of the United States of America」に掲載されました。
【研究背景と内容】
新型コロナウイルス感染症(COVID-19)などの呼吸器ウイルス感染症を制御することは極めて重要です。パンデミック時の感染症対策では、医薬品を使用しない非薬物的介入(自宅待機、3密回避、感染者隔離など)が中心的な役割を果たしてきました。一方で、ワクチンや抗ウイルス薬剤などの医薬品を用いた薬物的介入は、パンデミック終了後も重要な役割を果たします。特に、薬物的介入により呼吸器ウイルスのヒト間伝播を予防できれば、パンデミックを早い段階で制御できる可能性もあります。しかし、現行のmRNAワクチンではCOVID-19による重症化や死亡のリスクを著しく低減させましたが、感染伝播を防御する効果については焦点が当てられていませんでした。
新型コロナウイルス(SARS-CoV-2)は呼吸上皮に感染し、飛沫や空気感染を起こすため、「呼吸粘膜上に分布するS-IgA抗体がウイルス感染を防ぐうえで重要な役割を果たす」という仮説が考えられてきました。たとえば、鼻粘膜中のSARS-CoV-2祖先株に対するIgA抗体が高い個体では、オミクロンに対する感染リスクが低下することが過去に報告されています。ただし、SARS-CoV-2などの呼吸器ウイルスは、獲得免疫応答注3)が強く活性化される前に急速に呼吸上皮で増殖し、次の宿主に広がります。そのため、上気道におけるS-IgA抗体の存在が、SARS-CoV-2感染者の感染性ウイルス排出期間にどのように影響するかはこれまでよく理解されていませんでした。実際に、この仮説を検証するためには、自然免疫応答注4)から獲得免疫応答に切り替わるウイルス感染の超早期段階を踏まえたSARS-CoV-2感染者における感染性ウイルス排出と粘膜免疫応答の理解が不可欠となります。
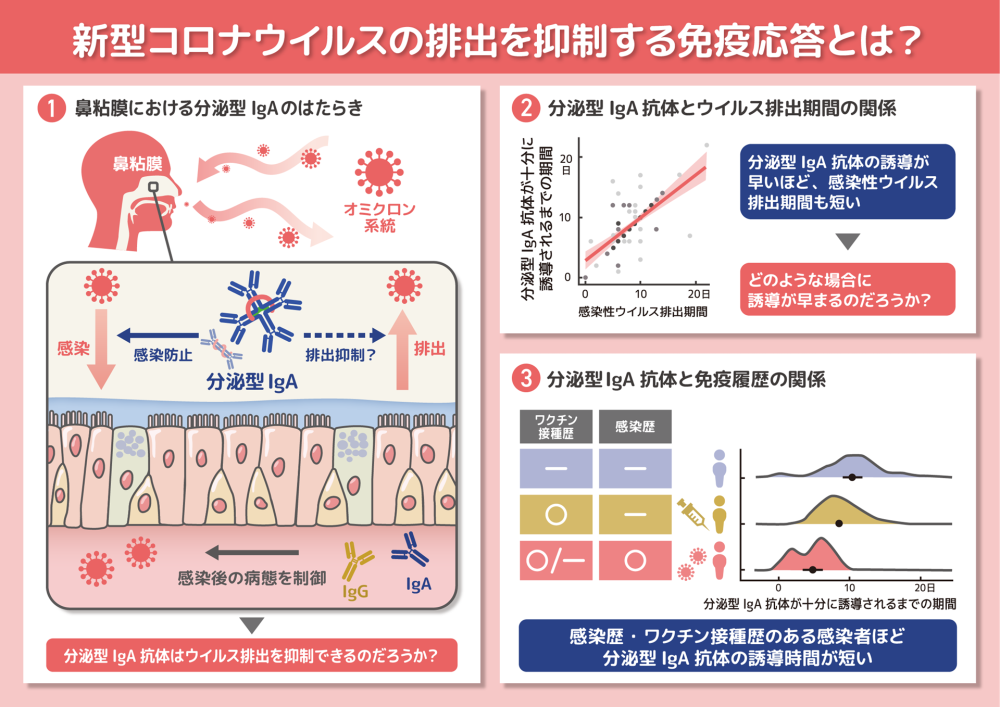
本研究では、The first few hundred調査で得られた合計122人の臨床・疫学情報に加えて、感染者の血清学的データと病原体データを分析しました。具体的には、オミクロンに感染した患者から収集された鼻咽頭検体を用いて、ウイルスRNA量、感染性ウイルス量、およびスパイクタンパク質に対するIgG、IgA、S-IgA抗体などの粘膜抗体のレベルを縦断的に測定し、数理モデルと統計モデルを用いて統合的に解析しました。その結果、S-IgA抗体はIgG抗体やIgA抗体と比較して、鼻粘膜のウイルス量や感染力を強く抑制する傾向を示すことを発見しました。さらに、上気道での感染性ウイルス排出期間と粘膜抗体応答との関係を詳細に追跡した結果、S-IgA抗体が誘導されるまでの時間と感染性ウイルス排出期間に正の相関があることが分かりました(図参照)。つまり、S-IgA抗体誘導が早い症例ほど感染性ウイルス排出期間が短くなり、S-IgA抗体がCOVID-19患者の感染性ウイルス排出を防ぐ可能性を示唆できました。また、検体に紐づいている臨床情報と照らし合わせた結果、過去のSARS-CoV-2への感染歴やワクチン接種歴がある感染者ほどS-IgA抗体の誘導時間が短くなるも明らかになりました(図参照)。
本研究は、COVID-19において分泌型粘膜抗体であるS-IgA抗体が感染性ウイルス排出を抑制する可能性をヒトで示した世界で初めての報告です。特に、呼吸器ウイルスの感染予防におけるS-IgA抗体抗体の臨床的意義を立証するものであり、呼吸器ウイルスによる将来のパンデミックを制御する技術の開発に弾みをつけるものです。
【成果の意義】
呼吸器ウイルスによるパンデミックでは、ワクチンや抗ウイルス薬剤による重症化や死亡の予防だけでなく、再感染を含めたヒト間伝播を制御・予防する課題が浮き彫りになりました。これによって医療システムが過負荷になるリスクを減少させ、患者への適切な医療を確保することができるからです。現在、これらの課題に対処できる方法の一つとして、呼吸器に対する粘膜ワクチンが考えられています。たとえば、鼻腔内粘膜ワクチンの臨床試験の実現可能性を向上させるためには、臨床的転帰を予測するための適切な免疫学的指標を特定する必要があります。
本研究では、誘導されるS-IgA抗体の量ではなく、S-IgA抗体の誘導時間に焦点を当てることで、呼吸器ウイルス感染者における感染性ウイルスの排出期間を説明できることを示しました。つまり、感染性ウイルス排出期間に関連する粘膜抗体応答を評価するための新しいアプローチを提案し、感染性ウイルス排出の制御に最も重要な寄与をする粘膜抗体を特定しました。この知見から、感染の超早期段階におけるS-IgA抗体誘導時間を短縮する医学的対策を開発することは、COVID-19のヒト間で伝播を減少させることができる鼻腔内粘膜ワクチンの開発において有用であり、現行のCOVID-19流行の制御だけでなく、次のパンデミックを防ぐ上でも重要だと期待できるようになります。
本研究は、2021年度から始まったJSTムーンショット型研究開発事業(目標2)およびAMED 新興・再興感染症に対する革新的医薬品等開発推進研究事業の支援のもとで行われたものです。
【用語説明】
注1)分泌型Ig-A抗体:
IgA(Immunoglobulin A;免疫グロブリンA)とは抗体の一種であり、特に、眼・鼻・喉や消化管などの外界と接する粘膜組織において、粘膜表面に分泌される多量体IgAのことを分泌型IgA(S-IgA)抗体と呼びます。
注2)The first few hundred調査:
未知の病原体が出現した際には、リスク評価や隔離期間の決定など、公衆衛生対応を迅速に行う必要がある。The first few hundred調査(FF100)とは、感染症による公衆衛生危機発生時に症例定義に合致した数百症例程度から通常のサーベイランスでは得られない知見を迅速に収集するための臨床・疫学調査である。
注3)獲得免疫応答:
感染した病原体を特異的に見分け、それを記憶することで、同じ病原体に出会った時に効果的に病原体を排除できる仕組みです。適応免疫とも呼ばれます。自然免疫に比べると、応答までにかかる時間は長く、数日かかります。
注4)自然免疫応答:
自然免疫は汎用的な免疫応答です。つまり特定の病原体に特異的な反応ではなく、異物や非自己分子全般を標的とします。これらはパターン認識受容体を介して病原体を検出し、その後迅速な免疫応答が行われます (数分から数時間以内)。
【論文情報】
雑誌名: Proceedings of the National Academy of Sciences of the United States of America
論文タイトル: Infectious virus shedding duration reflects secretory IgA antibody response latency after SARS-CoV-2 infection
著者(下記の他32名):
宮本 翔 国立感染症研究所 感染病理部 研究員
西山 尚来 名古屋大学大学院理学研究科理学専攻 博士課程
上野 朗 国立感染症研究所 感染病理部 修士課程
Hyeongki Park 名古屋大学大学院理学研究科理学専攻 特任助教
菅野 隆行 国立感染症研究所 感染病理部 主任研究官
中村 直俊 名古屋大学大学院理学研究科理学専攻 特任准教授
大園 誠也 国立感染症研究所 感染病理部 博士・技術員
合原 一幸 東京大学国際高等研究所 ニューロインテリジェンス国際研究機構(WPI-IRCN) 副機構長、東京大学特別教授
岩見 真吾 名古屋大学大学院理学研究科 教授
兼:京都大学高等研究院 ヒト生物学高等研究拠点(WPI-ASHBi)連携研究者、
九州大学マス・フォア・インダストリ研究所 客員教授、
理化学研究所数理創造プログラム 客員研究員、
東京大学国際高等研究所 ニューロインテリジェンス国際研究機構(WPI-IRCN)連携研究者
鈴木 忠樹 国立感染症研究所 感染病理部 部長
DOI: 10.1073/pnas.2314808120
URL: https://doi.org/10.1073/pnas.2314808120
【研究者連絡先】
東海国立大学機構 名古屋大学大学院理学研究科
兼: 京都大学高等研究院 ヒト生物学高等研究拠点(WPI-ASHBi) 連携研究者
九州大学マス・フォア・インダストリ研究所 客員教授
理化学研究所数理創造プログラム 客員研究員
東京大学国際高等研究所 ニューロインテリジェンス国際研究機構(WPI-IRCN)連携研究者
教授 岩見 真吾(いわみ しんご)
国立感染症研究所 感染病理部
部長 鈴木 忠樹(すずき ただき)
【報道連絡先】
東海国立大学機構 名古屋大学広報課
九州大学 広報課
京都大学高等研究院 ヒト生物学高等研究拠点 リサーチ・アクセラレーション・ユニット
東京大学国際高等研究所 ニューロインテリジェンス国際研究機構(WPI-IRCN)
広報担当
理化学研究所 広報室 報道担当
科学技術振興機構 広報課
国立感染症研究所 総務部調整課
【JST事業に関すること】
科学技術振興機構 ムーンショット型研究開発事業部
犬飼 孔(いぬかい こう)


